Un proceso isobárico, es un proceso termodinámico que ocurre a presión constante. En el calor transferido a presión constante está relacionado con el resto de variables mediante:
 ,
,Donde:
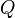 = Calor transferido.
= Calor transferido.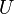 = Energía Interna.
= Energía Interna.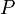 = Presión.
= Presión. = Volumen.
= Volumen.
En un diagrama P-V, un proceso isobárico aparece como una línea horizontal.
Proceso isobárico de un gas
Una expansión isobárica es un proceso en el cual un gas se expande (o contrae) mientras que la presión del mismo no varía, es decir si en un estado 1 del proceso la presión es P1 y en el estado 2 del mismo proceso la presión es P2, entonces P1 = P2. La primera ley de la termodinámica nos indica que:
- dQ = dU + dW
Entonces integrando la expresión anterior, tomando como estado inicial el estado 1 y estado final el estado 2, se obtiene:
 ..........(1)
..........(1)
Pero la fuerza 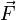 se puede expresar en función de la presión que se ejerce el gas, y el desplazamiento
se puede expresar en función de la presión que se ejerce el gas, y el desplazamiento  se puede escribir como dx, entonces:
se puede escribir como dx, entonces:
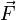 se puede expresar en función de la presión que se ejerce el gas, y el desplazamiento
se puede expresar en función de la presión que se ejerce el gas, y el desplazamiento  se puede escribir como dx, entonces:
se puede escribir como dx, entonces:
Pero Adx equivale a dV, el aumento en el volumen del gas durante esta pequeña expansión, entonces el trabajo efectuado por el gas sobre los alrededores como resultado de la expansión es:
- dW = PAdx = PdV ..........(2)
Ahora reemplazando (1) en (2) se puede integrar:
Como la presión P es constante, puede salir fuera de la integral:
Integrando:
Evaluando en los límites:
- Q2 − Q1 = U2 − U1 + P(V2 − V1)



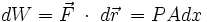


![[Q]_1^2 = [U]_1^2 + P[V]_1^2](http://upload.wikimedia.org/math/1/9/c/19cdd44053e4376e08a03df37aa01416.png)
No hay comentarios:
Publicar un comentario