Termodinamica
La termodinamica puede definirse como el tema de la Física que estudia los procesos en los que se transfiere energía como calor y como trabajo.
Sabemos que se efectúa trabajo cuando la energía se transfiere de un cuerpo a otro por medios mecánicos. El calor es una transferencia de energía de un cuerpo a un segundo cuerpo que está a menor temperatura. O sea, el calor es muy semejante al trabajo.
El calor se define como una transferencia de energía debida a una diferencia de temperatura, mientras que el trabajo es una transferencia de energía que no se debe a una diferencia de temperatura.
Al hablar de termodinamica, con frecuencia se usa el término "sistema". Por sistema se entiende un objeto o conjunto de objetos que deseamos considerar. El resto, lo demás en el Universo, que no pertenece al sistema, se conoce como su "ambiente". Se consideran varios tipos de sistemas. En un sistema cerrado no entra ni sale masa, contrariamente a los sistemas abiertos donde sí puede entrar o salir masa. Un sistema cerrado es aislado si no pasa energía en cualquiera de sus formas por sus fronteras.
Previo a profundizar en este tema de la termodinamica, es imprescindible establecer una clara distinción entre tres conceptos básicos: temperatura, calor y energía interna. Como ejemplo ilustrativo, es conveniente recurrir a la teoría cinética de los gases, en que éstos sabemos están constituidos por numerosísimas moléculas en permanente choque entre sí.
La temperatura es una medida de la energía cinética media de las moléculas individuales. El calor es una transferencia de energía, como energía térmica, de un objeto a otro debida a una diferencia de temperatura.
La energía interna (o térmica) es la energía total de todas las moléculas del objeto, o sea incluye energía cinética de traslación, rotación y vibración de las moléculas, energía potencial en moléculas y energía potencial entre moléculas. Para mayor claridad, imaginemos dos barras calientes de un mismo material de igual masa y temperatura. Entre las dos tienen el doble de la energía interna respecto de una sola barra. Notemos que el flujo de calor entre dos objetos depende de sus temperaturas y no de cuánta energía térmica o interna tiene cada uno. El flujo de calor es siempre desde el objeto a mayor temperatura hacia el objeto a menor temperatura.
Es una rama de la física que estudia los efectos de los cambios de magnitudes de los sistemas a un nivel macroscópico. Constituye una teoría fenomenológica, a partir de razonamientos deductivos, que estudia sistemas reales, sin modelizar y sigue un método experimental. Los cambios estudiados son los de temperatura, presión y volumen, aunque también estudia cambios en otras magnitudes, tales como la imanación , el potencial químico, la fuerza electromotriz y el estudio de los medios continuos en general. También podemos decir que la termodinámica nace para explicar los procesos de intercambio de masa y energía térmica entre sistemas térmicos diferentes. Para tener un mayor manejo especificaremos que calor significa "energía en tránsito" y dinámica se refiere al "movimiento", por lo que, en esencia, la termodinámica estudia la circulación de la energía y cómo la energía infunde movimiento. Históricamente, la termodinámica se desarrolló a partir de la necesidad de aumentar la eficiencia de las primeras máquinas de vapor.
Primera Ley de la Termodinamica
Primera ley de la termodinámica
También conocida como principio de conservación de la energía para la termodinámica — en realidad el primer principio dice más que una ley de conservación—, establece que si se realiza trabajo sobre un sistema o bien éste intercambia calor con otro, la energía interna del sistema cambiará. Visto de otra forma, esta ley permite definir el calor como la energía necesaria que debe intercambiar el sistema para compensar las diferencias entre trabajo y energía interna. Fue propuesta por Nicolas Léonard Sadi Carnot en 1824, en su obra Reflexiones sobre la potencia motriz del fuego y sobre las máquinas adecuadas para desarrollar esta potencia, en la que expuso los dos primeros principios de la termodinámica. Esta obra fue incomprendida por los científicos de su época, y más tarde fue utilizada por Rudolf Loreto Clausius y Lord Kelvin para formular, de una manera matemática, las bases de la termodinámica
Esta ley se expresa como:
Eint = Q - W
Cambio en la energía interna en el sistema = Calor agregado (Q) - Trabajo efectuado por el sistema (W)
Notar que el signo menos en el lado derecho de la ecuación se debe justamente a que W se define como el trabajo efectuado por el sistema.
Para entender esta ley, es útil imaginar un gas encerrado en un cilindro, una de cuyas tapas es un émbolo móvil y que mediante un mechero podemos agregarle calor. El cambio en la energía interna del gas estará dado por la diferencia entre el calor agregado y el trabajo que el gas hace al levantar el émbolo contra la presión atmosférica.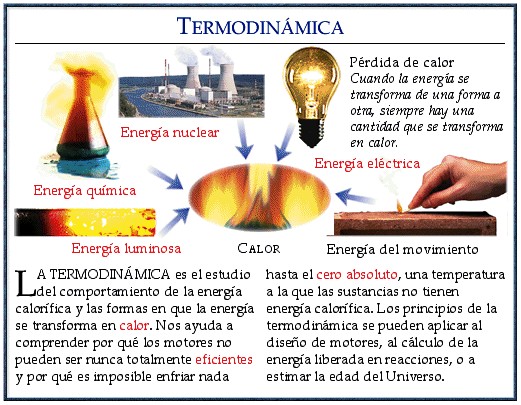

Segunda Ley de la Termodinamica
La primera ley nos dice que la energía se conserva. Sin embargo, podemos imaginar muchos procesos en que se conserve la energía, pero que realmente no ocurren en la naturaleza. Si se acerca un objeto caliente a uno frío, el calor pasa del caliente al frío y nunca al revés. Si pensamos que puede ser al revés, se seguiría conservando la energía y se cumpliría la primera ley.
Esta ley arrebata la dirección en la que deben llevarse a cabo los procesos termodinámicos y, por lo tanto, la imposibilidad de que ocurran en el sentido contrario (por ejemplo, que una mancha de tinta dispersada en el agua pueda volver a concentrarse en un pequeño volumen). También establece, en algunos casos, la imposibilidad de convertir completamente toda la energía de un tipo en otro sin pérdidas. De esta forma, la segunda ley impone restricciones para las transferencias de energía que hipotéticamente pudieran llevarse a cabo teniendo en cuenta sólo el Primer Principio. Esta ley apoya todo su contenido aceptando la existencia de una magnitud física llamada entropía , de tal manera que, para un sistema aislado (que no intercambia materia ni energía con su entorno), la variación de la entropía siempre debe ser mayor que cero

Tercera Ley de la Termodinamica
y Ley Cero de la Termodinamica
y Ley Cero de la Termodinamica
La Tercera de las leyes de la termodinámica, propuesta por Walther Nernst, afirma que es imposible alcanzar una temperatura igual al cero absoluto mediante un número finito de procesos físicos. Puede formularse también como que a medida que un sistema dado se aproxima al cero absoluto, su entropía tiende a un valor constante específico. La entropía de los sólidos cristalinos puros puede considerarse cero bajo temperaturas iguales al cero absoluto. No es una noción exigida por la Termodinámica clásica, así que es probablemente inapropiado tratarlo de “ley
Además de la primera y segunda leyes de la termodinámica, existen la ley cero y la tercera ley de la termodinámica
Ley Cero de la Termodinámica (de Equilibrio):
"Si dos objetos A y B están por separado en equilibrio térmico con un tercer objeto C, entonces los objetos A y B están en equilibrio térmico entre sí".
Como consecuencia de esta ley se puede afirmar que dos objetos en equilibrio térmico entre sí están a la misma temperatura y que si tienen temperaturas diferentes, no se encuentran en equilibrio térmico entre sí.
Tercera Ley de la Termodinámica.
La tercera ley tiene varios enunciados equivalentes:
"No se puede llegar al cero absoluto mediante una serie finita de procesos"
Es el calor que entra desde el "mundo exterior" lo que impide que en los experimentos se alcancen temperaturas más bajas. El cero absoluto es la temperatura teórica más baja posible y se caracteriza por la total ausencia de calor. Es la temperatura a la cual cesa el movimiento de las partículas. El cero absoluto (0 K) corresponde aproximadamente a la temperatura de - 273,16ºC. Nunca se ha alcanzado tal temperatura y la termodinámica asegura que es inalcanzable.
"La entropía de cualquier sustancia pura en equilibrio termodinámico tiende a cero a medida que la temperatura tiende a cero".
"La primera y la segunda ley de la termodinámica se pueden aplicar hasta el límite del cero absoluto, siempre y cuando en este límite las variaciones de entropía sean nulas para todo proceso reversible".
Ley Cero de la Termodinámica (de Equilibrio):
"Si dos objetos A y B están por separado en equilibrio térmico con un tercer objeto C, entonces los objetos A y B están en equilibrio térmico entre sí".
Como consecuencia de esta ley se puede afirmar que dos objetos en equilibrio térmico entre sí están a la misma temperatura y que si tienen temperaturas diferentes, no se encuentran en equilibrio térmico entre sí.
Tercera Ley de la Termodinámica.
La tercera ley tiene varios enunciados equivalentes:
"No se puede llegar al cero absoluto mediante una serie finita de procesos"
Es el calor que entra desde el "mundo exterior" lo que impide que en los experimentos se alcancen temperaturas más bajas. El cero absoluto es la temperatura teórica más baja posible y se caracteriza por la total ausencia de calor. Es la temperatura a la cual cesa el movimiento de las partículas. El cero absoluto (0 K) corresponde aproximadamente a la temperatura de - 273,16ºC. Nunca se ha alcanzado tal temperatura y la termodinámica asegura que es inalcanzable.
"La entropía de cualquier sustancia pura en equilibrio termodinámico tiende a cero a medida que la temperatura tiende a cero".
"La primera y la segunda ley de la termodinámica se pueden aplicar hasta el límite del cero absoluto, siempre y cuando en este límite las variaciones de entropía sean nulas para todo proceso reversible".
Att: Nancy elizbeth Olvera Gaspar.
No hay comentarios:
Publicar un comentario